1.1.1. Агарозный гель-электрофорез. Как его провести? Общая инструкция
Электрофорез в агарозном геле — один из наиболее простых и эффективных методов разделения фрагментов ДНК в широком диапазоне размеров (от 50 до 25 000 п.н.). Для проведения электрофореза препараты ДНК загружают в подготовленные лунки агарозного геля в специальной камере и подают электрический ток. Сахарофосфатный остов молекул ДНК и РНК заряжен отрицательно, поэтому в электрическом поле эти молекулы мигрируют к положительно заряженному аноду. Поскольку ДНК имеет одинаковое соотношение массы к заряду, её молекулы разделяются в геле в зависимости от размера: пройденное расстояние обратно пропорционально логарифму молекулярной массы.
Скорость миграции ДНК определяется следующими факторами:
-
размером молекулы;
-
концентрацией агарозы;
-
конформацией ДНК;
-
приложенным напряжением;
-
типом агарозы;
-
составом буферного раствора.
После завершения электрофореза результаты визуализируют. Подробнее о каждом этапе методики будет рассказано далее (Lee, P.Y., Costumbrado, J., Hsu, C.Y., Kim, Y.H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J. Vis. Exp. (62), e3923, doi:10.3791/3923 (2012). На рисунке 1 представлена общая схема работы при анализе нуклеиновых кислот (НК) методом электрофореза в агарозном геле.

Рисунок 1. Схема работы при анализе НК методом электрофореза в агарозном геле.
Приготовление агарозного геля
Начинайте готовить агарозный гель примерно за 30 минут до предполагаемого запуска электрофореза.
-
Приготовьте достаточный для заполнения камеры и приготовления геля объем загрузочного буфера (как правило, ТАЕ или ТВЕ). Подробнее о выборе буфера см. статью *1.2.2. Буферы для проведения агарозного гель-электрофореза — APGENA GENOMICA*.
-
Взвесьте на весах в колбе необходимое количество агарозы. Или, чтобы ускорить процесс, используйте предварительно взвешенную агарозу в таблетках. Агарозные гели готовят с использованием процентного раствора по следующей формуле:
Выбор концентрации агарозы в геле зависит от размера определяемых фрагментов ДНК. Чаще всего используют концентрации в диапазоне 0.5–2%. Подробнее см. статью 1.3.1. Выбор процентности агарозы — APGENA GENOMICA.
-
Добавьте 1х приготовленный ранее буфер в колбу с агарозой. Объем буфера не должен превышать 1/3 всего объема колбы.
-
Расплавьте агарозу, поместив колбу в микроволновую печь или на колбонагреватель, при периодическом перемешивании (рекомендуется вынимать колбу каждые 30 секунд и тщательно перемешивать). Продолжайте до полного растворения агарозы (раствор должен стать прозрачным).
-
Дайте расплавленной агарозе остыть до 55°С на столе или водяной бане. Более горячий раствор может повредить устройство для заливки гелей. Внесите выбранный краситель в агарозу, если это предусмотрено протоколом производителя для работы с данным красителем. Перемешайте. При использовании SafeGreen добавьте его автоматическим дозатором из расчёта 1 мкл 10 000х раствора красителя на каждые 10 мл раствора агарозы. При использовании бромистого этидия добавьте его автоматическим дозатором до конечной концентрации 0.5 мкг/мл. Подробнее см. статью 1.4.2. Выбор красителя для визуализации нуклеиновых кислот — APGENA GENOMICA.
-
Поместите лоток для приготовления геля в специальную форму для заливки. Или запечатайте лоток, если он открыт на концах (обычно используют клейкую ленту; см. рисунок 2, шаг 2). Для дополнительной герметизации можно нанести расплавленную агарозу на швы пипеткой.
-
Залейте расплавленную агарозу в лоток (см. рисунок 2: шаги 3, 4). Толщина геля должна составлять 3–5 мм. Установите гребенку для формирования лунок под загрузку ДНК. Убедитесь, что в геле нет пузырьков воздуха. Все пузыри необходимо удалить до остывания геля (используйте одноразовый наконечник пипетки).
Примечание для низкопроцентных гелей (<0.5%): Сначала залейте слой 1% геля без лунок. После его застывания нанесите сверху раствор агарозы нужной концентрации. Это предотвратит повреждение хрупкого геля при загрузке в камеру или фотографировании.
-
Оставьте гель остывать при комнатной температуре (до 30 минут). После застывания удалите гребенку и клейкую ленту (если использовалась). Гель можно использовать сразу или хранить в холодильнике при +4°C, завернутым в пищевую пленку или в специальном контейнере.
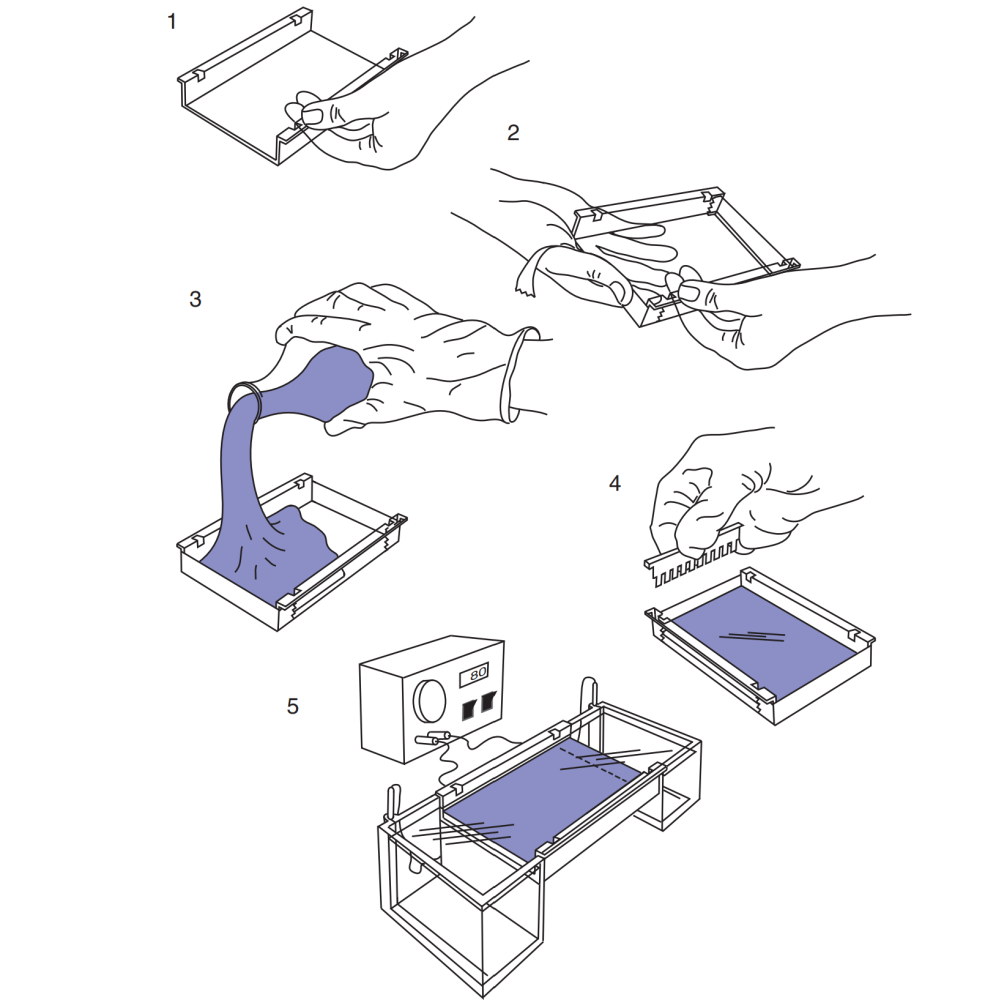
Подготовка камеры для проведения электрофореза, загрузка препаратов
Поместите лоток для заливки геля, содержащий застывший гель, в камеру для электрофореза. Налейте в камеру столько 1х буфера, чтобы слой буфера над гелем имел толщину 1 мм или чтобы поверхность лунок была погружена в буфер. Важно использовать тот же буфер, что применялся для приготовления геля. Убедитесь, что в лунках отсутствуют пузырьки воздуха.
Подготовьте необходимый объем препарата ДНК и смешайте его с 6х загрузочным буфером. Объем загрузочного буфера должен составлять 0.2 от желаемого конечного объема препарата в лунке. Подробнее о выборе загрузочного буфера см. статью 1.2.3. Загрузочные буферы. Как сделать, на основе чего выбрать. — APGENA GENOMICA.
Количество вносимой ДНК зависит от её типа. Лунку нельзя перегружать образцом — например, 500 нг на лунку шириной 0.5 см приведет к перегрузу. Перегруз проявляется растеканием, размазыванием и «улыбкой» полос. При использовании некрупных молекул ДНК (например, бактериофагов или плазмид) нагрузка 100–500 нг на лунку 0.5 см является допустимой. Если препарат содержит множество фрагментов ДНК разного размера (например, ДНК млекопитающих после обработки рестриктазами), максимальное количество может быть увеличено до 20–30 мкг.
Максимальный объем, который можно загрузить, определяется размером лунки. Типичная лунка (0.5×0.5×0.15 см) вмещает до 37.5 мкл. Однако заполнять её полностью не рекомендуется — это повышает риск контаминации образцов (M.R. Green and J. Sambrook. Cold Spring Harb Protoc; doi:10.1101/pdb.prot100404.. Cold Spring Harbor Laboratory Press. HEALTH SCIENCES on January 2, 2019).
Внесите препараты автоматической пипеткой в лунку геля (см. рисунок 3). Образец ДНК с загрузочным буфером не должен превышать объем лунки. После загрузки образцов добавьте маркер молекулярных масс, соответствующий задачам исследования.
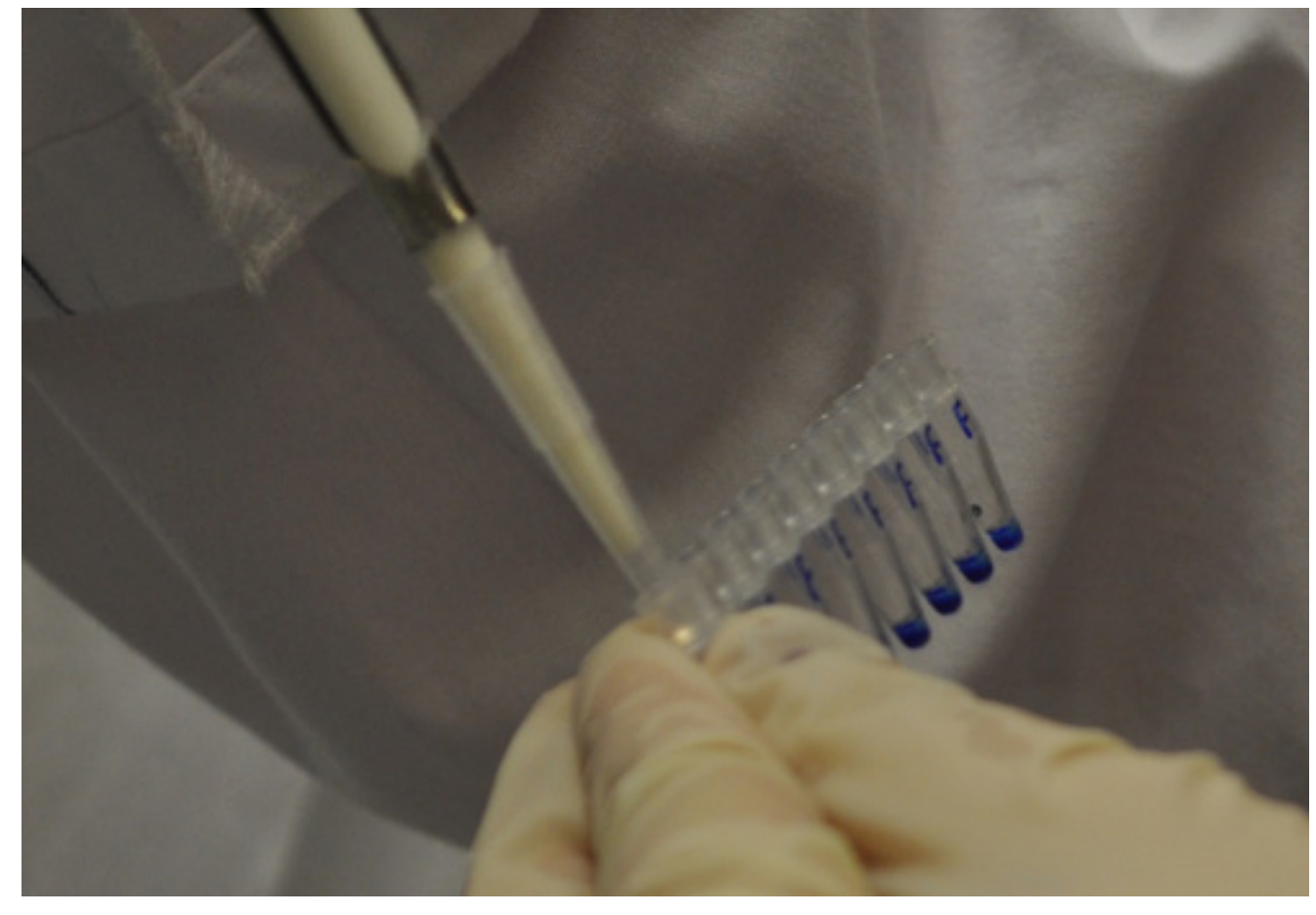 |
 |
| Рисунок 3. А. Внесение загрузочного буфера в образцы ДНК | Б. Нанесение препарата в гель |
Запуск электрофореза
Закройте камеру крышкой. Убедитесь, что электроды правильно подключены к камере (так, чтобы ДНК мигрировала к аноду — положительному полюсу красного цвета). Установите напряжение на требуемый уровень и запустите электрофорез. Подробнее о выборе напряжения см. статью 1.3.3. Напряженность поля при агарозном электрофорезе. Как выбрать — APGENA GENOMICA. Ход разделения можно контролировать по движению красителя в загрузочном буфере.
Внимание! Камеру для электрофореза всегда необходимо накрывать крышкой и размещать вдали от активных рабочих зон во избежание поражения электрическим током.

Для проверки корректности подключения источника питания убедитесь в наличии пузырьков на аноде и катоде (см. рисунок 4). На положительно заряженном аноде, в сторону которого двигается ДНК выделяется в два раза меньший объём газа (кислорода), чем на отрицательно заряженном катоде (водорода).
Завершение электрофореза. Визуализация результатов
Отключите источник питания, когда краситель достигнет уровня, достаточного для разделения ДНК. Последующие действия (окрашивание или его отсутствие) зависят от типа используемого красителя — следуйте инструкции производителя.
Если применялся бромистый этидий, результаты визуализируйте с помощью УФ-трансиллюминатора или трансиллюминатора синего света SuperRay с системой гель-документации. Для современных красителей, таких как SafeGreen используйте трансиллюминатор синего света SuperRay с системой гель-документации.
Используемая литература:
- Asubel/ Resolution and recovery of large section ii DNA fragments. Current Protocols in Molecular Biology // 2000. — 2.5A.1-2.5A.9)
- Lee PY, Costumbrado J, Hsu CY, Kim YH. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. 2012 Apr 20;(62):3923. doi: 10.3791/3923. PMID: 22546956; PMCID: PMC4846332
- Koontz L. Agarose gel electrophoresis. Methods Enzymol. 2013;529:35-45. doi: 10.1016/B978-0-12-418687-3.00004-5. PMID: 24011035.
- M.R. Green and J. Sambrook. Cold Spring Harb Protoc; doi:10.1101/pdb.prot100404.. Cold Spring Harbor Laboratory Press. HEALTH SCIENCES on January 2, 2019.